高考化學(xué)沖刺,化學(xué)反應(yīng)速率知識(shí)總結(jié)
2018-12-28 21:31:34三好網(wǎng)
一、化學(xué)反應(yīng)速率
1.表示方法
通常用單位時(shí)間內(nèi)反應(yīng)物濃度的減少或生成物濃度的增加來(lái)表示。
2.?dāng)?shù)學(xué)表達(dá)式及單位

3.規(guī)律
同一反應(yīng)在同一時(shí)間內(nèi),用不同物質(zhì)來(lái)表示的反應(yīng)速率可能不同,但反應(yīng)速率的數(shù)值之比等于這些物質(zhì)在化學(xué)方程式中的化學(xué)計(jì)量數(shù)之比。
4.注意事項(xiàng)
(1)描述反應(yīng)速率時(shí)應(yīng)指明具體物質(zhì)。
(2)一般來(lái)說(shuō),化學(xué)反應(yīng)速率隨反應(yīng)的進(jìn)行而逐漸減慢。某一段時(shí)間內(nèi)的反應(yīng)速率,實(shí)際上是一段時(shí)間內(nèi)的平均速率,而不是指瞬時(shí)速率。
(3)無(wú)論是反應(yīng)物還是生成物,其化學(xué)反應(yīng)速率值都取正值。
(4)由于一個(gè)化學(xué)反應(yīng)里各物質(zhì)之間化學(xué)計(jì)量數(shù)不一定相同,所以,在同一個(gè)化學(xué)反應(yīng)里,用不同物質(zhì)表示的化學(xué)反應(yīng)速率不一定相同。但是,各物質(zhì)的化學(xué)反應(yīng)速率之比等于它們的化學(xué)計(jì)量數(shù)之比。
(5)固體或純液體(注意:不是溶液)的物質(zhì)的量濃度可視為不變的常數(shù),一般不用于表示化學(xué)反應(yīng)速率。
二、影響化學(xué)反應(yīng)速率的因素
1.內(nèi)因(主要因素)
反應(yīng)物本身的性質(zhì)。
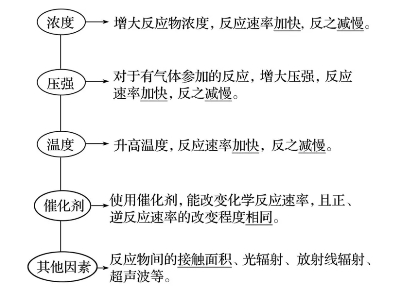
2.外因(其他條件不變,只改變一個(gè)條件)
三、有效碰撞理論
1.活化分子、活化能、有效碰撞
(1)活化分子
能夠發(fā)生有效碰撞的分子。
(2)活化能
活化分子比普通分子所高出的能量。活化能越小,普通分子就越容易變成活化分子。(如圖)
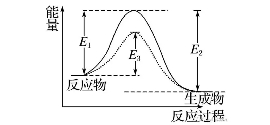
圖中:E1為正反應(yīng)的活化能,使用催化劑時(shí)的活化能為E3,反應(yīng)熱為E1-E2。(注:E2為逆反應(yīng)的活化能)
(3)有效碰撞
活化分子之間能夠引發(fā)化學(xué)反應(yīng)的碰撞。
(4)活化能與化學(xué)反應(yīng)速率的關(guān)系
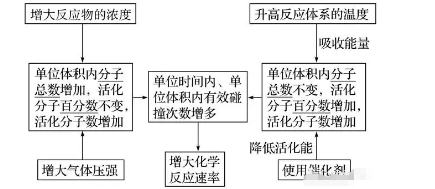
在一定條件下,活化分子所占的百分?jǐn)?shù)是固定不變的。活化分子的百分?jǐn)?shù)越大,單位體積內(nèi)活化分子數(shù)越多,單位時(shí)間內(nèi)有效碰撞的次數(shù)越多,化學(xué)反應(yīng)速率越快。
2.活化分子、有效碰撞與反應(yīng)速率的關(guān)系
氣體反應(yīng)體系中充入惰性氣體(不參與反應(yīng))時(shí)對(duì)反應(yīng)速率的影響
(1)恒容
充入“惰性氣體”―→總壓增大―→物質(zhì)濃度不變(活化分子濃度不變)―→反應(yīng)速率不變。
(2)恒壓
充入“惰性氣體”―→體積增大―→物質(zhì)濃度減小(活化分子濃度減小)―→反應(yīng)速率減小。
三、解題貼士
1.計(jì)算速率時(shí)易忽略體積,用物質(zhì)的量變化值除以時(shí)間。
2.化學(xué)反應(yīng)速率大小的比較方法
由于同一化學(xué)反應(yīng)的反應(yīng)速率用不同物質(zhì)表示時(shí)數(shù)值可能不同,所以比較反應(yīng)的快慢不能只看數(shù)值的大小,而要進(jìn)行一定的轉(zhuǎn)化。
(1)看單位是否統(tǒng)一,若不統(tǒng)一,換算成相同的單位。
(2)換算成同一物質(zhì)表示的速率,再比較數(shù)值的大小。
(3)比較化學(xué)反應(yīng)速率與化學(xué)計(jì)量數(shù)的比值。
3.對(duì)于較為復(fù)雜的關(guān)于反應(yīng)速率的題目(“三段式”法)
(1)寫(xiě)出有關(guān)反應(yīng)的化學(xué)方程式。
(2)找出各物質(zhì)的起始量、轉(zhuǎn)化量、某時(shí)刻量。
(3)根據(jù)已知條件列方程式計(jì)算。














