高考化學沖刺,化學平衡圖像知識總結
2018-12-28 20:58:42三好網

曲線的意義是外界條件(如溫度、壓強等)對正、逆反應速率影響的變化趨勢及變化幅度。圖中交點是平衡狀態,溫度增大后逆反應速率增大得快,平衡向逆向移動;壓強增大后正反應速率增大得快,平衡向正向移動。
題型二 百分含量(或轉化率)-時間-溫度(壓強)圖像
已知不同溫度或壓強下,反應物的轉化率α(或百分含量)與時間的關系曲線,推斷溫度的高低及反應的熱效應或壓強的大小及氣體物質間的化學計量數的關系。
[以A(g)+B(g)―→C(g)中反應物的轉化率αA為例說明]

(1)“先拐先平,數值大”原則
分析反應由開始(起始物質相同時)達到平衡所用時間的長短可推知反應條件的變化。
①若為溫度變化引起,溫度較高時,反應達平衡所需時間短。如甲中T2>T1。
②若為壓強變化引起,壓強較大時,反應達平衡所需時間短。如乙中p1>p2。
③若為是否使用催化劑,使用適宜催化劑時,反應達平衡所需時間短。如圖丙中a使用催化劑。
(2)反應規律的判斷方法
①圖甲中,T2>T1,升高溫度,αA降低,平衡逆移,正反應為放熱反應。
②圖乙中,p1>p2,增大壓強,αA升高,平衡正移,則正反應為氣體體積縮小的反應。
③若縱坐標表示A的百分含量,則甲中正反應為吸熱反應,乙中正反應為氣體體積增大的反應。
題型三 恒溫線(或恒壓線)圖像
已知不同溫度下的轉化率-壓強圖像或不同壓強下的轉化率-溫度圖像,推斷反應的熱效應或反應前后氣體物質間化學計量數的關系。
[以A(g)+B(g)―→C(g)中反應物的轉化率αA為例說明]

(1)通過分析相同溫度下不同壓強時反應物A的轉化率大小來判斷平衡移動的方向,從而確定反應方程式中反應物與產物氣體物質間的化學計量數的大小關系。如甲中任取一條溫度曲線研究,壓強增大,αA增大,平衡正移,正反應為氣體體積減小的反應,乙中任取橫坐標一點作橫坐標垂直線,也能得出結論。
(2)通過分析相同壓強下不同溫度時反應物A的轉化率的大小來判斷平衡移動的方向,從而確定反應的熱效應。如利用上述分析方法,在甲中作垂直線,乙中任取一曲線,即能分析出正反應為放熱反應。
題型四 幾種特殊圖像
(1)對于化學反應mA(g)+nB(g)pC(g)+qD(g),M點前,表示化學反應從反應物開始,則v正 >v逆;M點為剛達到的平衡點。M點后為平衡受溫度的影響情況,即升溫,A%增大(C%減小),平衡左移,ΔH<0。
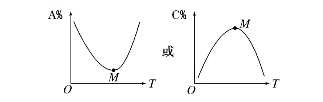
(2)對于化學反應mA(g)+nB(g)pC(g)+qD(g),L線上所有的點都是平衡點。

左上方(E點),A%大于此壓強時平衡體系中的A%,E點必須朝正反應方向移動才能達到平衡狀態,所以,E點v正>v逆;則右下方(F點)v正<v逆。














