高一上學期化學氧化還原反應問題解析總結
2019-01-11 21:04:41三好網
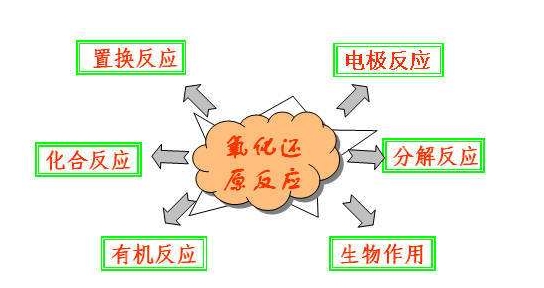
一、氧化還原反應各概念之間的關系
1、反應類型:
氧化反應:物質所含元素化合價升高的反應。
還原反應:物質所含元素化合價降低的反應。
氧化還原反應:有元素化合價升高和降低的反應。
2、反應物:
氧化劑:在反應中得到電子的物質
還原劑:在反應中失去電子的物質
3、產物:
氧化產物:失電子被氧化后得到的產物
還原產物:得電子被還原后得到的產物
4、物質性質:
氧化性:氧化劑所表現出得電子的性質
還原性:還原劑所表現出失電子的性質
5、各個概念之間的關系如下圖
【例題1】下列變化過程屬于還原反應的是( )
A. HCl→MgCl2
B. Na→Na+
C. CO→CO2
D. Fe3+→Fe
【例題2】下列化學反應不屬于氧化還原反應的是( )
A.3Cl2 + 6KOH =5KCl + KClO3 + 3H2O
B.2NO2+ 2NaOH =NaNO3 +NaNO2 +H2O
C.SnCl4+ 2H2O = SnO2 + 4HCl
D.3CCl4+ 2K2Cr2O7 = 2CrO2Cl2 +3COCl2 +2KCl
答案:【例題1】D;【例題2】C
二、常見的氧化劑與還原劑
1、物質在反應中是作為氧化劑還是作為還原劑,主要取決于元素的化合價。
(1)元素處于最高價時,它的原子只能得到電子,因此該元素只能作氧化劑,如+7價的Mn和+6價的S
(2)元素處于中間價態時,它的原子隨反應條件不同,既能得電子,又能失電子,因此該元素既能作氧化劑,又能作還原劑,如0價的S和+4價的S
(3)元素處于最低價時,它的原子則只能失去電子,因此該元素只能作還原劑,如-2價的S
2、重要的氧化劑
(1)活潑非金屬單質,如F2、Cl2、Br2、O2等。
(2)元素處于高價時的氧化物、高價含氧酸及高價含氧化酸鹽等,如MnO2,NO2;濃H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
(3)過氧化物,如Na2O2,H2O2等。
3、重要的還原劑
(1)金屬單質,如Na,K,Zn,Fe等。
(2)某些非金屬單質,如H2,C,Si等。
(3)元素處于低化合價時的氧化物,如CO,SO2等。
(4)元素處于低化合價時的酸,如HCl(濃),HBr,HI,H2S等。
(5)元素處于低化合價時的鹽,如Na2SO3,FeSO4等。
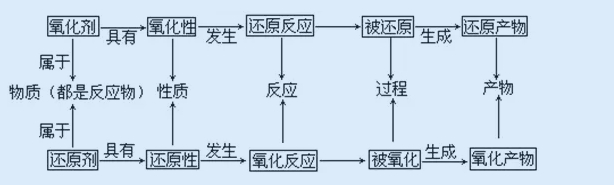
三、電子轉移的表示方法
電子轉移的表示方法有雙線橋法和單線橋法:
1、雙線橋法
要點:
(1)箭頭由反應物中化合價變化元素指向生成物中化合價已經變化了的同一元素。(升高、降低各一根箭頭,越過方程式中間的等號)
(2)電子轉移數目:化合價升高、失電子;化合價降低、得電子。化合價改變元素的原子個數m×每個原子得到(或失去)電子的個數ne-,即m×ne-。如:

2、單線橋法
要點:
(1)線橋從反應物中化合價升高的元素出發,指向反應物中化合價降低的元素,箭頭對準氧化劑中化合價降低的元素,箭頭不過“=”
(2)在線橋上標明轉移電子總數,不寫得到或失去。如:
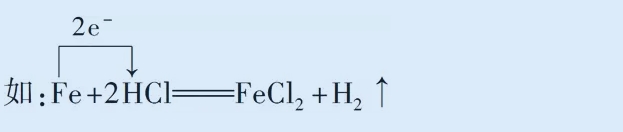
四、氧化還原反應的反應規律
1、價態規律
同種元素,處于最高價態時只具有氧化性。處于最低價態時只具有還原性。處于中間價態時既有氧化性又有還原性。
【例題】下列微粒不具有還原性的是( )
A. K
B. Fe2+
C. S2-
D. Na+
答案:D
2、歧化和歸中規律
價態歸中規律:同種元素不同價態之間發生氧化還原反應時,價態的變化“只靠攏,可相交,不相叉”。
3、反應先后規律
在濃度相差不大的溶液中:
(1)同時含有集中還原劑時,加入氧化劑后,還原性強的優先被氧化。
(2)同時含有集中氧化劑時,加入還原劑后,氧化性強的優先被還原。
4、守恒規律
在任何氧化還原反應中:化合價升高總數 = 化合價降低總數,還原劑失電子總數 = 氧化劑得電子總數。并且反應前后電荷數相等。
【例題】已知3個SO32-恰好將2個ClO4-還原,而SO32-被氧化為SO42-,則X元素在還原產物中的化合價是( )
A. +1
B.+2
C.+3
D.+4
答案:D
五、氧化性與還原性的強弱判斷規律
1、根據氧化還原反應方程式的判斷
氧化性:氧化劑>氧化產物
還原性:還原劑>還原產物
可總結為:比什么性,找什么劑,產物之性弱于劑。
2、根據金屬活動性順序判斷
K Ca Na Mg AlZn Fe Sn Pb (H) Cu Hg Ag Pt Au
從左向右還原性逐漸減弱,對應離子的氧化性逐漸增強
3、根據反應條件和反應的劇烈程度
反應條件要求越低,反應越劇烈,對應物質的氧化性或還原性越強。
4、根據氧化性還原反應的程度
相同條件下:
(1)不同氧化劑作用于同一種還原劑,氧化產物價態高的氧化性強。
(2)不同還原劑作用于同一種氧化劑,還原產物價態低的還原性強。
六、氧化還原反應方程式的配平
1、三個原則:得失電子守恒原則,原子守恒原則,電荷守恒原則
2、一般方法:化合價升降法聯合最小公倍數法
3、配平技巧:
(1)正向配平法:先從氧化劑和還原劑開始配平。
適用范圍:分子間的氧化還原反應,所有元素參與的氧化還原反應,生成物中物質即是氧化物又是還原產物。
(2)逆向配平法:先從氧化還原產物開始配平。
適用范圍:自身氧化還原反應,反應物中某一部分被氧化或被還原
(3)整體配平發:當某一元素的原子或原子團(多見于有機反應配平)在某化合物中有數個時,可將它作為一個整體對待,根據化合物中元素化合價代數和為零的原則予以整體標價。
(4)缺項配平法
如果所給的化學方程式中有反應物或生成物沒有寫出來,在配平時,如果所空缺的物質不發生電子的得失,僅僅是提供一種發生反應的酸、堿、中性的環境,可先把有化合價升降的元素配平,最后根據電荷守恒和原子守恒確定缺項物質,配平。
【例題】BiO3-+ Mn2++ =Bi3++ MnO4-+ H2O
分析:首先根據化合價的升降配平有變價元素的有關物質:
5BiO3-+2 Mn2++ =5Bi3++2 MnO4-+H2O
根據氧原子守恒,可以確定H2O的系數為7,根據質量守恒和電荷守恒規律可以確定反應物所缺的是氫離子H+
(5)其他配平法
①奇偶配平法
這種方法適用于化學方程式兩邊某一元素多次出現,并且兩邊的該元素原子總數有一奇一偶,例如:C2H2+O2→CO2+H2O。
此方程式配平從先出現次數最多的氧原子配起。
O2內有2個氧原子,無論化學式前系數為幾,氧原子總數應為偶數。故右邊H2O的系數應配2(若推出其它的分子系數出現分數則可配4),由此推知C2H2前2,式子變為:2C2H2+O2→CO2+2H2O,由此可知CO2前系數應為4,最后配單質O2為5,把短線改為等號,寫明條件即可:2C2H2+5O2==4CO2+2H2O。
②觀察法配平
有時方程式中會出現一種化學式比較復雜的物質,我們可通過這個復雜的分子去推其他化學式的系數,例如:Fe+H2O——Fe3O4+H2。
Fe3O4化學式較復雜,顯然,Fe3O4中Fe來源于單質Fe,O來自于H2O,則Fe前配3,H2O前配4,則式子為:3Fe+4H2O=Fe3O4+H2,由此推出H2系數為4,寫明條件,短線改為等號即可:3Fe+4H2O==Fe3O4+4H2。
③歸一法
找到化學方程式中關鍵的化學式,定其化學式前計量數為1,然后根據關鍵化學式去配平其他化學式前的化學計量數。若出現計量數為分數,再將各計量數同乘以同一整數,化分數為整數,這種先定關鍵化學式計量數為1的配平方法,稱為歸一法。
做法:選擇化學方程式中組成最復雜的化學式,設它的系數為1,再依次推斷。
七、氧化還原反應的相關計算(舉例說明,不少于2個例子)
1、計算依據:氧化劑得到的電子總數等于還原劑失去的電子總數。
2、計算公式:氧化劑的物質的量×變價元素原子的個數×化合價的變化值等=還原劑的物質的量×變價元素原子的個數×化合價的變化值。
【例題1】ClO2是一種消毒殺菌效率高、二次污染小的水處理劑,實驗室可以通過以下反應制得ClO2:反應方程式為2KClO3+H2C2O4+H2SO4==加熱==2ClO2↑+K2SO4+2CO2↑+2H2O,下列說法正確的是( )
A.KClO3在反應中得到電子
B.ClO2是氧化產物
C.H2C2O4在反應中被還原
D.1molKClO3參加反應有2mol電子轉移
答案:A
解析:由反應方程式知:KClO3中Cl元素化合價由+5→+4,H2C2O4中碳元素的化合價由+3→+4,故KClO3得電子,是氧化劑,被還原得還原產物ClO2,1molKClO3參加反應轉移1mol電子;H2C2O4是還原劑被氧化,故A項正確。
【例題2】將11.2g的Mg和Cu的混合物完全溶解于足量的硝酸中,收集反應產生的氣體X,再向所得溶液中加入適量的NaOH溶液,產生21.4g沉淀,根據題意推斷氣體X的成分可能是( )
A.0.3mol NO2和0.3mol NO
B. 0.2mol NO2和0.1molN2O4
C. 0.1mol NO、0.2mol NO2和0.05mol N2O4
D. 0.6mol NO
答案:C
解析:根據Mg、Cu的變化:Mg~Mg2+~2OH-~Mg(OH)2~2e-、Cu~Cu2+~2OH-~Cu(OH)2~2e-知增加的質量為OH-的質量,轉移電子的物質的量與OH-的物質的量相等,則有n(OH-)=21.4g-11.2 g/17g·mol-1=0.6 mol,故反應轉移的電子的物質的量也為0.6mol。
選項A轉移電子的物質的量為0.3mol×1+0.3mol×3 =1.2 mol,不正確;選項B轉移電子的物質的量為0.2mol×1+0.1mol×2 =0.4 mol,不正確;選項C轉移電子的物質的量為0.1mol×3+0.2mol×1+ 0.05mol×2 = 0.6 mol,正確;選項D轉移電子的物質的量為0.6mol×3=1.8mol,不正確.
【例題3】足量銅與一定量濃硝酸反應得到硝酸銅溶液和NO2、N2O4、NO的混合氣體,這些氣體與1.68LO2(標準狀況)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是( )
A.60mL
B.45mL
C.30mL
D.15mL
答案:A
解析:本題在氧化還原反應中屬于連續反應,這類題型在計算過程中只需考慮始末元素化合價的變化,在整個過程相當于Cu在失去電子,O2在得到電子。Cu化合價升高2個,O的化合價降低兩個,則:
n(Cu)×1×(2-0)=n(O2)×2×〔0-(-2)〕
得n(Cu)=0.15mol
根據化學式Cu(NO3)2,可知n(NO3-)=0.15mol×2。但加NaOH溶液后,NO3-最終與Na+結合,所以n(Na+)=n(NO3-)=0.3mol,進而求得所需5mol/LNaOH溶液的體積是60mL。














