化學反應速率與化學平衡復習
2019-01-18 20:51:07三好網
考點1 化學反應速率
1.化學反應速率基本概念
用單位時間內反應物濃度的減少或生成物濃度的增加來表示。常用單位為mol·(L·s)-1或mol·(L·min)-1
說明:
(1)固體、純液體在反應中可視為濃度不變,故一般不用固體或純液體表示反應速率。
(2)反應速率一般是指某段時間內的平均速率,非即時速率,不能為負數。(馬上點標題下藍字"高中化學"關注可獲取更多學習方法、干貨!)
2.化學反應速率的規律
同一反應,用不同物質表示的速率之比,等于化學方程式中化學計量數之比。
【方法點擊】
近幾年的高考題,在涉及化學反應速率的知識點時,主要是利用化學反應速率的規律,完成下述要求:
1.在一個反應中,由一種物質的反應速率,換算為其他物質的反應速率。
2.比較同一反應在不同的條件下,用不同物質表示的反應速率的相對大小。
3.由速率之比寫出有關方程式
現舉例說明如下:

考點2影響化學反應速率的因素
1.內在因素(主要因素)
反應物的性質
2.外在因素
(1)濃度:在其他條件不變時,增大反應物的濃度,化學反應速率增大。由于固體、純液體在反應中可視為濃度不變,故增加其量并不能改變反應速率。
(2)溫度:在其他條件不變時,升高溫度,化學反應速率增大。
(3)壓強:在其他條件不變時,對于有氣體參加的反應,增大壓強,化學反應速率增大。
(4)催化劑:在其他條件不變時,加入催化劑,化學反應速率增大。
(5)其他:光、電磁波、反應物顆粒的大小等也會影響反應速率。
【方法點擊】
1.壓強對速率的影響,是通過改變氣體的濃度來實現的,故一般意義上的增大壓強是指壓縮氣體的體積。對于氣體反應體系要注意以下幾個問題。

2.化學反應速率與化學平衡的關系
(1)改變溫度,對吸熱反應速率的影響,總是超過對放熱反應速率的影響:當升高溫度時,吸熱反應速率增大的倍數>放熱反應速率增大的倍數,故升溫化學平衡向吸熱方向移動;當降低溫度時,吸熱反應速率減小的倍數>放熱反應速率減小的倍數,故降溫化學平衡向放熱方向移動。
(2)對有氣體參加的化學反應,改變壓強,對氣體體積之和大的一側的反應速率的影響,總是超過對氣體體積之和小的一側的反應速率的影響:當增大壓強時,氣體體積之和大的一側的反應速率增大的倍數>氣體體積之和小的一側的反應速率增大的倍數,故加壓化學平衡向氣體體積之和小的一側移動;當減小壓強時,氣體體積之和大的一側的反應速率減小的倍數>氣體體積之和小的一側的反應速率減少的倍數,故減壓化學平衡向氣體體積之和大的一側移動。
(3)使用催化劑,正、逆反應速率增加或減小的倍數相同,故化學平衡不移動。
3.化學知識點多,而理綜試卷化學高考題的題量較少,所以化學高考題每一道題涉及的知識點都比較多。綜合考慮各種因素對反應速率的影響進行命題,符合這一命題趨勢。
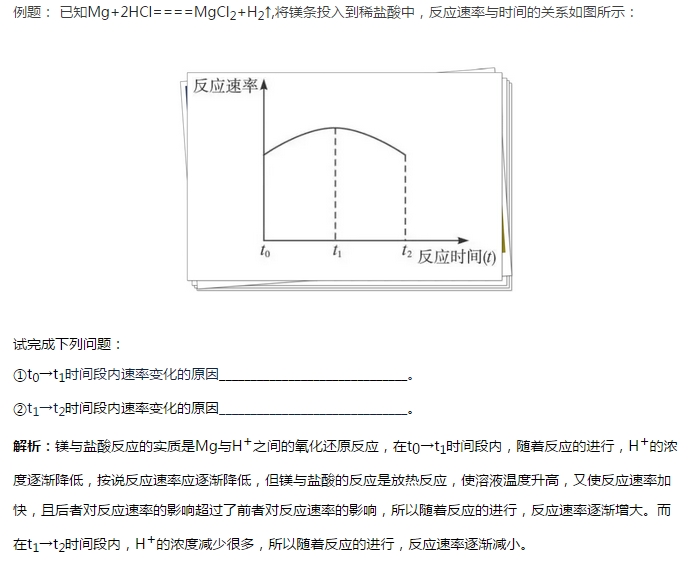
考點3化學平衡
1.概念:
在一定條件下的可逆反應里,正反應和逆反應的速率相等,反應混合物中各組成成分的含量保持不變的狀態叫化學平衡狀態。
2.特點:
“等”——處于密閉體系的可逆反應,化學平衡狀態建立的條件是正反應速率和逆反應速率相等。即v(正)=v(逆)≠O。這是可逆反應達到平衡狀態的重要標志。
“定”——當一定條件下可逆反應一旦達平衡(可逆反應進行到最大的程度)狀態時,在平衡體系的混合物中,各組成成分的含量(即反應物與生成物的物質的量,物質的量濃度,質量分數,體積分數等)保持一定而不變(即不隨時間的改變而改變)。這是判斷體系是否處于化學平衡狀態的重要依據。
“動”——指定化學反應已達化學平衡狀態時,反應并沒有停止,實際上正反應與逆反應始終在進行,且正反應速率等于逆反應速率,所以化學平衡狀態是動態平衡狀態。
“變”——任何化學平衡狀態均是暫時的、相對的、有條件的(與濃度、壓強、溫度等有關)。而與達平衡的過程無關(化學平衡狀態既可從正反應方向開始達平衡,也可以從逆反應方向開始達平衡)。當外界條件變化時,原來的化學平衡即被打破,在新的條件不再改變時,在新的條件下建立起新的化學平衡。新平衡時正、逆反應速率,各組成成分的含量均與原平衡不同。
3.化學平衡常數

考點4平衡移動原理
如果改變影響平衡的一個條件(如濃度、壓強或溫度等),平衡就向能夠減弱這種改變的方向移動。它是濃度、壓強和溫度等外界條件對平衡移動影響的概括和總結,只適用于已經達到平衡狀態的可逆反應,未處于平衡狀態的體系不能用此原理分析,但它也適用于其他動態平衡體系,如溶解平衡、電離平衡和水解平衡等。催化劑能夠同等程度地增加正反應速率和逆反應速率,因此它對化學平衡的移動沒有影響。
考點5有關化學平衡的基本計算
(1)物質濃度的變化關系
反應物:平衡濃度=起始濃度-轉化濃度
生成物:平衡濃度=起始濃度+轉化濃度
其中,各物質的轉化濃度之比等于它們在化學方程式中物質的計量數之比。

(5)化學平衡計算的關鍵是準確掌握相關的基本概念及它們相互之間的關系。化學平衡的計算步驟,通常是先寫出有關的化學方程式,列出反應起始時或平衡時有關物質的濃度或物質的量,然后再通過相關的轉換,分別求出其他物質的濃度或物質的量和轉化率。概括為:建立解題模式、確立平衡狀態方程。說明:
①反應起始時,反應物和生成物可能同時存在;
②由于起始濃度是人為控制的,故不同的物質起始濃度不一定是化學計量數比,若反應物起始濃度呈現計量數比,則隱含反應物轉化率相等,且平衡時反應物的濃度成計量數比的條件。
③起始濃度,平衡濃度不一定呈現計量數比,但物質之間是按計量數反應和生成的,故各物質的濃度變化一定成計量數比,這是計算的關鍵。
考點6化學反應速率&化學平衡圖像分析
首先要看清楚橫軸和縱軸意義(特別是縱軸。表示轉化率和表示反應物的百分含量情況就完全相反)以及曲線本身屬等溫線還是等壓線(當有多余曲線及兩個以上條件時,要注意“定一議二”);然后找出曲線上的特殊點,并理解其含義(如“先拐先平”);再根據縱軸隨橫軸的變化情況,判定曲線正確走勢,以淘汰錯誤的選項。具體情況如下:
(1)對于化學反應速率的有關圖像問題,可按以下的方法進行分析:
①認清坐標系,搞清縱、橫坐標所代表的意義,并與有關的原理掛鉤。
②看清起點,分清反應物、生成物,濃度減小的是反應物,濃度增大的是生成物一般生成物多數以原點為起點。
③抓住變化趨勢,分清正、逆反應,吸、放熱反應。升高溫度時,v(吸)>v(放),在速率-時間圖上,要注意看清曲線是連續的還是跳躍的,分清漸變和突變,大變和小變。例如,升高溫度,v(吸)大增,v(放)小增,增大反應物濃度,v(正)突變,v(逆)漸變。
④注意終點。例如在濃度-時間圖上,一定要看清終點時反應物的消耗量、生成物的增加量,并結合有關原理進行推理判斷。
(2)對于化學平衡的有關圖像問題,可按以下的方法進行分析:
①認清坐標系,搞清縱、橫坐標所代表的意義,并與勒夏特列原理掛鉤。
②緊扣可逆反應的特征,搞清正反應方向是吸熱還是放熱,體積增大還是減小、不變,有無固體、純液體物質參加或生成等。
③看清速率的變化及變化量的大小,在條件與變化之間搭橋。
④看清起點、拐點、終點,看清曲線的變化趨勢。
⑤先拐先平。例如,在轉化率-時間圖上,先出現拐點的曲線先達到平衡,此時逆向推理可得該變化的溫度高、濃度大、壓強高。
⑥定一議二。當圖像中有三個量時,先確定一個量不變再討論另外兩個量的關系。
特別提醒:
1.等效平衡:在兩種不同的初始狀態下,同一個可逆反應在一定條件(定溫、定容或定溫、定壓)下分別達到平衡時,各組成成分的物質的量(或體積)分數相等的狀態。在恒溫恒容條件下,建立等效平衡的一般條件是:反應物投料量相當;在恒溫恒壓條件下,建立等效平衡的條件是:相同反應物的投料比相等。
2.平衡移動的思維基點
(1)“先同后變”,進行判斷時,可設置相同的平衡狀態(參照標準),再根據題設條件觀察變化的趨勢;
(2)“不為零原則”,對于可逆反應而言,無論改變任何外部條件,都不可能使其平衡體系中的任何物質濃度變化到零。














