高考有機化學二輪復習苯及其同系物知識點
2019-01-03 21:15:16三好網
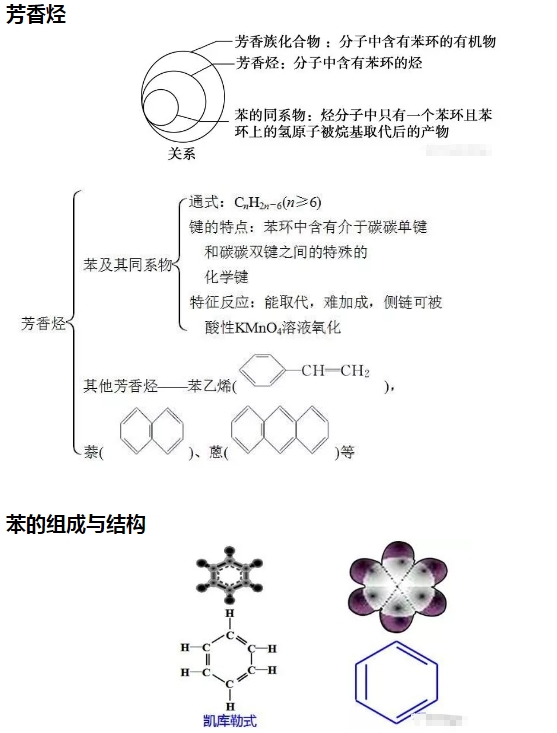
苯的結構特點
(1)苯分子為平面正六邊形結構。
(2)分子中6個碳原子和6個氫原子共平面。
(3)6個碳碳鍵完全相同,是一種介于碳碳單鍵和碳碳雙鍵之間的特殊化學鍵。
3.苯的化學性質
(1)苯不能被酸性KMnO4溶液氧化,但能燃燒。苯燃燒時,發出明亮而且帶有濃煙的火焰,這是由于苯分子含碳量高,碳燃燒不充分。其燃燒的化學方程式為:
2C6H6+15O2→12CO2+6H2O
(2)在有催化劑FeBr3存在時,苯與液溴發生反應,苯環上的氫原子被溴原子取代,生成溴苯。
(3)苯與濃硝酸和濃硫酸的混合物共熱至50~60 ℃發生反應,苯環上的氫原子被硝基(—NO2)取代,生成硝基苯。
(4)苯雖然不具有像烯烴一樣典型的碳碳雙鍵,但在特定條件下,仍能發生加成反應,在鎳作催化劑的條件下,苯可以與氫氣發生加成反應。
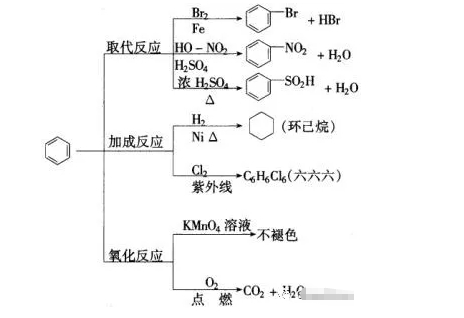
溴苯的制備實驗

實驗裝置分析
① 分液漏斗,可以通過控制液溴的量,控制反應的量;
② 用四氯化碳除溴蒸氣;
③ 長導管可以使反應液冷凝回流;
④ 實驗結束,打開A下端的活塞,讓反應液流入B中,充分振蕩,目的是除去溶于溴苯中的溴。(Br2+2NaOH==NaBr+NaBrO+H2O)
⑤ 若證明苯和液溴發生的是取代反應,而不是加成反應,可向試管D中加入AgNO3溶液,若產生淡黃色沉淀,則能證明。
注意事項:
①用液溴,不能用溴水;
②不用加熱;
③防倒吸;
苯的同系物
通式:CnH2n-6(n>6)
結構特點
①分子中含有一個苯環
②與苯環相連的是烷烴基
主要的化學性質
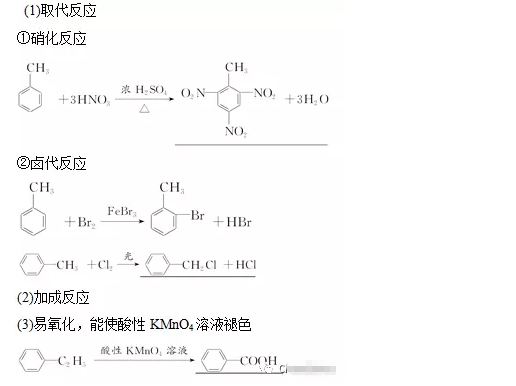
(1)怎樣證明苯與溴發生的是取代反應而不是加成反應?
答案:生成了溴化氫分子。
(2)液溴與苯的反應催化劑為FeBr3,若實驗中換加Fe粉,實驗同樣能夠成功,為什么?
答案:因為Fe粉可與液溴反應生成FeBr3。
(3)苯與溴的取代產物溴苯為無色、不溶于水且比水重的油狀液體,而實驗中得到的溴苯因溶有溴而呈黃褐色,如何提純得到無色的溴苯?
答案:將呈黃褐色的溴苯與NaOH溶液混合,充分振蕩后靜置,使液體分層,然后分液。
(4)用濃溴水、苯、鐵粉三者混合反應直接制取溴苯,未能獲得成功,為什么?
答案:應該用液溴代替濃溴水。
(5)苯的硝化反應中要用濃硫酸作催化劑和吸水劑,如何混合濃硫酸和濃硝酸?
答案:將濃H2SO4沿試管內壁慢慢注入濃硝酸中,并不斷振蕩。
(6)怎樣控制反應溫度為50~60℃?
答案:在50~60℃的水中水浴加熱。
(7)苯的同系物被酸性KMnO4溶液氧化的規律是什么?
答案:(1)苯的同系物或芳香烴側鏈為烴基時,不管烴基碳原子數為多少,只要直接與苯環相連的碳原子上有氫原子,均能被酸性KMnO4溶液氧化為羧基,且羧基直接與苯環相連。并不是所有苯的同系物都能使酸性KMnO4溶液褪色,如就不能,原因是與苯環直接相連的碳原子上沒有氫原子。
(8)如何檢驗苯乙烯中含有甲苯?
答案:檢驗苯的同系物之前必須先排除碳碳雙鍵的干擾。取適量樣品于試管中,先加入足量Br2的CCl4溶液充分反應后,再滴加酸性高錳酸鉀溶液振蕩,若高錳酸鉀溶液褪色,證明含有甲苯。














